Abstract
Le sempre maggiori
richieste prestative che si ritrovano nell’ambito dello sport professionistico,
impongono un’ottimizzazione delle tecniche di recupero funzionale in seguito ad
insulto traumatico. In questo lavoro viene dapprima brevemente descritta
l’eziologia biomeccanica del danno strutturale che l’unità muscolo tendinea può
subire nel corso di un evento di
tipo traumatico ed in seguito vengono sinteticamente descritti processi di
riparazione tissutale post-traumatici.
Parole chiave: lesione muscolare,
riparazione muscolare, recupero funzionale.
Introduzione
L’evento lesivo a livello muscolare, costituisce uno degli insulti
traumatici più ricorrenti in ambito sportivo. L’entità della lesione può andare
dal semplice stiramento, spesso associato a rottura dei piccoli vasi, con
comparsa di dolore e tumefazione, sino allo strappo muscolare completo. Le
conseguenze per lo sportivo, che appaiono ovviamente correlate all’entità della
lesione subita, sono sempre comunque sgradevoli e comportano nella totalità dei
casi una sospensione, più o meno
lunga, dell’attività agonistica e
l’attuazione di un’ idonea terapia fisica.
Lo scopo di questo scritto è quello di analizzare gli eventi fisiologici
che normalmente caratterizzano l’evento traumatico e di descrivere, seppur
sommariamente, i meccanismi di riparazione muscolare.<
Danno strutturale e modalità di contrazione
Il danno strutturale della
fibra muscolare può essere causato, sia da una singola contrazione
muscolare, come dall’effetto cumulativo di una serie di contrazioni (Armstrong,
e coll., 1991). In ogni caso, il meccanismo maggiormente correlato al possibile
danneggiamento della fibra muscolare, risulterebbe essere la contrazione di
tipo eccentrico (Armstrong, 1990; Garret, 1990). La ragione della maggior
incidenza traumatica a livello muscolare, riscontrabile durante una situazione
di contrazione eccentrica, è soprattutto imputabile alla maggior produzione di
forza registrabile nel corso di quest’ultima, rispetto a quanto non avvenga
nella modalità di attivazione di tipo concentrico od isometrico (Stauber,
1989; Garret, 1990). Infatti,
durante una contrazione eccentrica, effettuata alla velocità di 90° · s-1,
la forza espressa dal distretto muscolare risulta essere di ben tre volte
maggiore rispetto a quella espressa, alla stessa velocità, durante una
contrazione concentrica (Middleton e coll., 1994). Inoltre, durante una
contrazione eccentrica, risulterebbe maggiore anche la forza prodotta dagli
elementi passivi del tessuto connettivo del muscolo sottoposto ad allungamento
(Elftman, 1966). Soprattutto in riferimento a quest’ultimo dato, occorre
sottolineare come anche il fenomeno puramente meccanico dell’elongazione, possa
giocare un ruolo importante nell’insorgenza dell’evento traumatico, considerato
che quest’ultimo può verificarsi, sia in un muscolo che si presenti attivo durante la fase di
stiramento, come in un distretto muscolare che sia passivo durante la fase di
elongazione (Garrett e coll., 1987). Durante la contrazione eccentrica il
muscolo è in effetti sottoposto ad un fenomeno di “overstretching” che, in
quanto tale, può determinare
l’insorgenza di lesioni a livello dell’inserzione tendinea, della giunzione
muscolo-tendinea, oppure a livello di una zona muscolare resa maggiormente
fragile da un deficit di vascolarizzazione (Middleton e coll., 1994). E’
interessante notare come siano i
muscoli pluarticolarii quelli maggiormente esposti ad insulti
traumatici, proprio per il fatto di dover controllare, attraverso la
contrazione eccentrica, il range articolare di due o più articolazioni (Brewer,
1960). Anche la diversa tipologia delle fibre muscolari presenta una differente
incidenza in termini di evento traumatico. Le fibre a contrazione rapida (FT),
sono infatti maggiormente esposte a danni strutturali rispetto a quelle a
contrazione lenta (ST), probabilmente a causa della loro maggior capacità
contrattile, che si traduce in un’accresciuta produzione di forza, e di
velocità di contrazione, rispetto alle fibre di tipo ST (Garret e coll., 1984;
Friden e Lieber, 1992). Inoltre i muscoli che presentano un’alta percentuale di
FT, sono generalmente più superficiali (Lexell e coll., 1983) e normalmente interessano due o
più articolazioni, fattori
entrambi predisponenti al danno strutturale (Brewer, 1960; Garret, 1990).
Inoltre, è interessante notare come l’insulto traumatico sia prevalentemente
localizzato a livello della giunzione muscolo-tendinea, a testimonianza del
fatto che in questa zona, come del resto nella porzione finale della fibra
muscolare, si verifichi il maggior stress meccanico (Garrett, 1990; Garrett e
coll., 1987; Lieber e coll., 1991). In ultimo, occorre sottolineare il
particolare aspetto metabolico connesso alla contrazione di tipo eccentrico.
Durante la contrazione di tipo eccentrico, dal momento che la vascolarizzazione
muscolare viene transitoriamente interrotta in concomitanza al meccanismo di
contrazione, il lavoro svolto diviene
di tipo anaerobico; questo determina, sia un aumento della temperatura
locale, che dell’acidosi, oltre ad una marcata anossia cellulare. Questi eventi
metabolici si traducono in un’aumentata fragilità muscolare ed in una possibile
necrosi cellulare, sia a livello muscolare, che del connettivo di sostegno
(Middleton e coll., 1994).
L’elemento distintivo che differenzia una lesione muscolare da una lesione a
livello osseo è rappresentato dal
fatto che il muscolo scheletrico si risana attraverso un fenomeno
di riparazione mentre il danno osseo viene ripristinato grazie ad un processo di rigenerazione. La maggior parte dei
tessuti biologici corporei, nel
momento cui viene danneggiata,
risana attraverso un processo che comunque esita nella formazione di un’area cicatriziale , che
rappresenta un tessuto diverso rispetto a quello pre-esistente. Al contrario
quando un segmento osseo viene lesionato, il tessuto rigenerato risulta identico rispetto al tessuto
pre-esistente. Il processo di riparazione
di un muscolo scheletrico lesionato segue ineluttabilmente un pattern costante, indipendentemente
dalla causa che ha causato la lesione stessa, contusione, stiramento o strappo
che sia ( Hurme e coll., 1991;
Kalimo e coll., 1997). In
questo tipo di processo sono
identificabili sostanzialmente tre
fasi:
1) la fase di distruzione, che è caratterizzata dalla rottura e
dalla conseguente necrosi delle fibre muscolari, dalla formazione di un ematoma
tra i monconi delle fibre lesionate e dalla reazione infiammatoria cellulare.
2) La fase di riparazione,
che consiste nella fagocitosi del tessuto necrotizzato, nella rigenerazione delle fibre e nella concomitante produzione di tessuto
cicatriziale connettivo contestuale alla crescita capillare nella zona
lesionale. .
3) La fase di rimodellamento,
periodo durante il quale avvengono la maturazione delle fibre rigenerate, la
contrazione, ossia la riduzione, e
la riorganizzazione del tessuto cicatriziale ed, in ultimo, il
recupero delle capacità funzionali del muscolo.
Le ultime due fasi, di riparazione e di
rimodellamento, sono solitamente associate o sovrapponibili (Kalimo e
coll., 1997).
Le tre settimane
post-lesionali
I processi di riparazione
muscolare si completano in un periodo di circa tre settimane durante il quale
si susseguono delle tappe biologiche ben precise e scadenzate che possiamo
schematicamente illustrare in sei fasi fondamenatali come di seguito
illustrato:
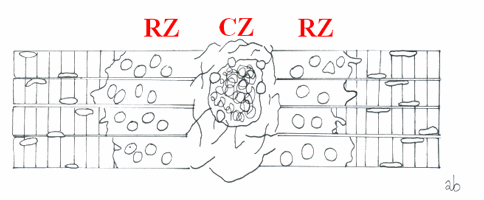
Figura 1. Secondo
giorno post-lesionale : le parti necrotizzate delle fibre muscolari sono state
rimosse dai macrofagi mentre, contestualmente, è cominciata la formazione, da
parte dei fibroblasti, del tessuto connettivo di cicatrizzazione all’interno
della zona centrale (CZ).

Figura 2. Terzo
giorno post-lesionale : le cellule satellite hanno già dato inizio alla loro
attivazione che ha luogo all’interno dei cilindri della lamina basale nella zona di
rigenerazione (RZ).

Figura 3. Quinto
giorno post-lesionale: i mioblasti si aggregano all’interno dei miotubi della RZ
ed il tessuto connettivo della CZ comincia a diventare più denso.

Figura 4. Settimo
giorno post-lesionale: la rigenerazione delle cellule muscolari si estende al di
fuori dei vecchi cilindri della lamina basale, sin nella zona CZ ed inizia a penetrare attraverso la zona
cicatriziale.
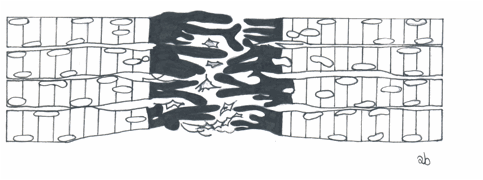
Figura 5. Quattordicesimo
giorno post-lesionale: la zona cicatriziale nella zona CZ si è ulteriormente condensata e ridotta di
dimensioni e le miofibre rigenerate colmano il gap residuo della zona CZ.

Figura 6. Ventunesimo
giorno post-lesionale: l’intreccio delle miofibre è virtualmente completato con
l’interposizione di una piccola quantità di tessuto cicatriziale. La quantità
di tessuto cictariziale è comunque inversamente correlata alla qualità dei
processi riparativi stessi.
La necrosi delle fibre muscolari.
Nel momento in cui
un muscolo scheletrico viene lesionato, generalmente si può osservare un’eccessiva forza meccanica, che si
estende attraverso l’intera sezione trasversale di ogni singola fibra e che causa la rottura del sarcoplasma all’interno dei monconi
delle fibre già lesionate, lasciando quest’ultimo ampiamente aperto. Dal
momento che le miofibrille (e conseguentemente le fibre muscolari) sono, da un punto di vista strutturale,
delle cellule di notevole lunghezza e dalla forma allungata ed affusolata, sussiste un rischio
reale che il processo di necrosi, iniziato nella sede della lesione, si estenda
lungo l’intera lunghezza della fibra stessa. Tuttavia, esiste una speciale struttura
anatomica, denominata banda di contrazione
(contraction band), costituita da una zona di materiale citoscheletrico
particolarmente denso, che si comporta coma una vera e propria “porta
tagliafuoco” (Hurme e col., 1991). Nell’arco di alcune ore successive
all’evento traumatico, la propagazione del processo necrotico è bloccata da un
processo locale rappresentato da una sorta di sigillo effettuato dalla banda di
contrazione a livello delle zone alterate della membrana cellulare. In tal modo,
si crea una sorta di barriera protettiva all’interno della quale può essere
riparata la lacerazione della membrana cellulare (Hurme e coll., 1991). Recenti
studi hanno inoltre dimostrato come le vescicole lisosomiali, che si trovano
all’interno del sito di distruzione della membrana cellulare, rivestano il ruolo
di una membrana temporanea, e svolgano un compito centrale nel processo di
guarigione della membrana cellulare stessa (Mcneil, 2002 ; Miyake e coll.,
2001).
La fase
infiammatoria
Contestualmente alla lesione delle fibre muscolari,
nell’evento traumatico, vengono
lacerati anche i vasi sanguigni del tessuto muscolare leso. In tal modo, le
cellule infiammatorie trasportate dal flusso sanguigno hanno direttamente
accesso al sito di lesione. La reazione infiammatoria è in seguito
“amplificata” dal fatto che le cellule satellite e le pari necrotizzate delle
fibre muscolari lese, rilasciano diverse sostanze ( denominate wound hormones), che si comportano da
chemio-attrattivi accrescendo, in tal modo, lo stravaso delle cellule infiammatorie (Chazaud e coll.,
2003; Hirata e coll., 2003;
Tidball, 1995). All’interno del muscolo leso, si possono osservare macrofagi e fibroblasti che vengono
attivati dando origine a dei segnali chemio- tattici addizionali (growth
factors, citochine e chemiochine), diretti alle cellule infiammatorie
circolanti. In aggiunta a questi fattori di crescita, prodotti ex novo, la
maggior parte di tessuto contiene fattori di crescita stoccati in forma attiva
all’interno della sua matrice extra cellulare (ECMs) pronti per essere utilizzati
nei casi di urgente necessità, come appunto ad esempio nella riparazione di una
lesione (Rak e Kerbel, 1997). Nel caso d’insulto tissutale, la distruzione
dell’integrità del normale tessuto biologico, dipende dal rilascio e
dall’attivazione dei fattori di crescita ECMs-dipendenti (ossia ai fattori di
cresita legati alla ECMs) e dalla loro capacità di dar inizio ai processi
riparativi (Ragk e Kerbel, 1997). In particolare, esistono evidenze dirette che
il Tumor Necrosis Factor –α (TNF-α) riveste un importante ruolo
fisiologico nel processo rigenerativo del muscolo scheletrico lesionato, la cui
dimostrazione è data dal fatto che, se la sua attività viene inibita durante il
processo di guarigione, si registra un leggero deficit delle capacità
riparative del muscolo scheletrico stesso (Warren e coll., 2002). Inoltre, un
gran numero di fattori di crescita e di citochine, come i membri della famiglia
dei fattori di crescita fibroblastici (Fibroblastic Growth Factors, FGF), dei
fattori di crescita insulino-simili (IGF) e dei Transforming Growth Factors
–β (TGF-β); gli Hepatocyte Growth Factors (HGF) e gli
Interleuchina -1β (IL-1β) ed Interleuchina-6, sono conosciuti per la
loro espressione durante i traumi muscolari. D’altronde, è altresì probabile che molti altri fattori, come
il fattore di crescita piastrinico (Pleteled-Derived- Growth-Factor), siano
presenti nel corso delle varie tappe che si registano a fronte di un insulto
muscolare (Burkin e Kaufman, 1999; Mishra e coll., 1995), o quantomeno, che la
loro espressione possa essere indotta, nell’ambito del muscolo scheletrico, da
stimoli fisiologici simili a quelli che causano le lesioni micro-traumatiche,
come i fenomeni di overstretching, oppure ad eventi correlati all’utilizzo di carichi meccanici esterni non consoni alle caretteristiche
muscolari del soggetto (Burkin e Kaufman 1999; Perrone e coll., 1995). Considerando
il fatto che questi fattori di crescita costituiscono dei potenti attivatori
mitogenici per numerosi tipi di cellule, è probabile che possano anche essere
coinvolti nell’attivazione dei processi rigenerativi del muscolo scheletrico
lesionato (Best e coll., 2001; Burkin e Kaufman, 1999; Chargé e Rudnicki, 2004).
Un certo numero di questi fattori di crescita, come il FGFs, IGF1, IGF2,
TGF-β, HGF, TNF-α ed il IL-6, sono dei potenziali attivatori della
proliferazione dei precursori cellulari miogeni ( MP, Myogenic Precursor Cell, ossia
le cellule satellite) (29). Alcuni di loro sono anche dei potenti stimolatori
per la differenziazione degli MPC ed in seguito, nel corso dei processi rigenerativi, per quanto riguarda la fusione dei miotubi in miofibre
multinucleate mature (Best e
coll., 2001; Burkin e Kaufman, 1999; Chargé e Rudnicki, 2004). Nella vera e
propria fase acuta susseguente ad un evento lesivo muscolare, i leucociti
polimorfonucleati risultano essere
le cellule più abbondanti presenti sul sito di lesione (Brickson e
coll., 2001; Brickson e coll., 2003; Hurme e coll., 1991; Schneider e coll., 2002;
Thorsson e coll., 1998) ma, entro
il primo giorno, sono sostititi dai monociti. In funzione dei principi di base su cui si regge un processo infiammatorio, questi monociti
sono eventualmente trasformati in macrofagi, che vengono attivamente ingaggiati
nella proteolisi e nella fagocitosi del materiale necrotico, grazie al rilascio
di enzimi lisosomiali (Best e Hunter, 2001; Farges e coll., 2002; Hurme e
coll., 1991; Timballi, 1995). La fagocitosi da parte dei macrofagi costituisce
un processo altamente specifico a carico del materiale necrotico. In questa
fase, i cilindri intatti della lamina basale circondano la parte necrotizzata
della cellule sopravvissute che sono state lasciate intatte dagli attacchi dei
macrofagi e che, conseguentemente, verranno utilizzate come impalcatura (scaffold) all’interno del quale le cellule stallite in grado di
sopravvivere, inizieranno la formazione di nuove miofibre ( Grounds, 1991; Hurme
e Kalimo., 1992; Hurme e Kalimo,
1991) Un’affascinate dimostrazione
dell’incredibile specificità e dell’alta coordinazione di questo processo, è
data dal fatto che i macrofagi, nel momento stesso in cui fagocitano i residui necrotici che circondano le cellule satellite, inviano
simultaneamente dei fattori di sopravvivenza specifici per queste cellule
rigenerative (Chazaud e coll., 2003). E’ inoltre importante sottolineare, come
il trauma lesionale comporti una contestuale rottura del reticolo
sarcoplasmatico ed una conseguente fuoruscita degli ioni calcio in esso
contenuti. Il drastico aumento di
ioni calcio all’interno delle fibra muscolare stessa determina, nelle 24-48 ore
post-lesionali, una contrazione riflessa della miofibille all’interno e nei
dintorni della zona di lesione. Questo fenomeno comporta una fase di autoaggravemento
della lesione che si protrae in
funzione del periodo di contrazione muscolare riflessa dovuta a questa fase
definita con il termine di “calcium overload” (Armstrong e col.,
1991)
La fase di
riparazione e rimodellamento e la rigenerazione delle fibre muscolari
Una volta che la fase di distruzione è diminuita
d’intensità, inizia il reale processo di riparazione del muscolo lesionato, che
si articola attraverso due concomitanti processi che si dimostrano tra loro, allo stesso
tempo, complementari ed
antagonisti : la rigenerazione delle miofibre distrutte e delle loro rispettive
innervazioni e la formazione di tessuto di cicatrizzazione. Una progressione
bilanciata di questi due processi, costituisce il pre-requisito essenziale per
un ottimale ripristino delle funzioni contrattili del muscolo scheletrico
(Hurme e Kalimo, 1991; Kalimo e coll., 1997). Nonostante il fatto che le fibre muscolari siano in linea generale considerate come
fibre di tipo irreversibilmente post-mitotico, il comunque notevole potenziale
rigenerativo del muscolo scheletrico è garantito da un meccanismo intrinseco in
grado di ripristinare l’apparato contrattile lesionato. Di conseguenza, un pool
di riserva di cellule indifferenziate, denominate cellule satellite, sono, durante
lo sviluppo fetale, dislocate a parte al di sotto della lamina basale di ogni singola fibra
muscolare (Hurme e Kalimo, 1992; Kalimo e coll., 1997; Rantenen e coll., 1995).
In risposta all’evento lesivo, queste particolari cellule, dapprima proliferano,
in seguito si differenziano in mioblasti ed alla fine del processo, si collegano con le restanti fibre formando dei miotubi multinucleati. I miotubi multinucleati di recente
formazione si fondono, in un secondo tempo, con la parte della fibra lesa che è sopravvissuta al trauma
iniziale (Hurme e Kalimo, 1992). Infine, la parte di miofibra rigenerata
acquisisce la sua forma matura con una normale striatura e con i mionuclei
dislocati perifericamente (Hurme e Kalimo, 1992). Curiosamente, in risposta a traumi molto blandi, come nel
caso ad esempio una di singola elongazione eccentrica che provoca un trauma di
lieve entità, le cellule satellite rispondono immediatamente, iniziando a
proliferare ma, a causa della limitatezza del trauma e della rapida risposta
“intrinseca” di riparazione da parte delle fibre del muscolo leso, autobloccano la propria attivazione
prima ancora che si formino
i mioblasti (Äärimaa e coll., 2004). Nel muscolo scheletrico maturo esistono
almeno due popolazioni principali di cellule satellite (Jancowski e coll., 2002; Kalimo e coll., 1997; Qu-Petersen e coll., 2002; Rantanen e
coll., 1995; Rouger e coll., 2004 ; Zammit e coll., 2004). Le cellule satellite “classiche”, che risiedono al di
sotto della lamina basale della fibra muscolare, possono infatti essere
suddivise in “committed satellite cells”, cellule stallite che sono pronte a
differenziarsi in mioblasti
immediatamente dopo l’evento lesivo, ed in “cellule satellite staminali” (stem satellite cell), che debbono
invece essere prima sottoposte a
divisione cellulare, per poi potersi differenziare (Kalimo e coll., 1997; Rantanen e coll., 1995;
Zammit e coll., 2004). Attraverso
questa divisione cellulare, la popolazione di stem satellite cells, ricostituisce la riserva di cellule
satellite per una futura possibile richiesta rigenerativa (Rantanen e coll.,
1995; Zammit e coll., 2004). Tra queste popolazioni di cellule satellite, si
può inoltre notare l’esistenza di una sottopopolazione di cellule capaci di
differenziarsi, al di là delle linee miogeniche, non solamente in linee
mesenchimali ma anche in quelle neurali od endoteliali (Jankowski e coll.,
2002; Qu-Petersen e coll., 2002). Sino ad oggi, le cellule satellite erano
ritenute la sola risorsa del mionucleo nel corso del processo di riparazione
muscolare (Chargé e Rudnicki, 2004), recenti scoperte hanno invece dimostrato la presenza di due differenti popolazioni di cellule
staminali multipotenti che possono contribuire alla rigenerazione del muscolo
scheletrico lesionato: le “cellule staminali non-muscolo-residenti” e le “cellule
staminali muscolo-residenti” (Chargé e Rudnicki, 2004). Anche alcuni progenitori cellulari
isolati dal midollo osseo (BM), il compartimento neuronale, e diversi tessuti
mesenchimali, sono in grado di differenziarsi in linee miogeniche. Le cellule
derivate dal BM, non solo contribuiscono alla rigenerazione delle fibre
muscolari nel muscolo scheletrico lesionato ma sono anche in grado di
reintegrare il pool delle cellule satellite nel muscolo scheletrico insultato
(Labarge e Blau 2002). In ogni modo, è importante notare che la frequenza alla
quale questi eventi accadono, sembra essere molto bassa (anche nel caso di
lesione), se comparata con il numero di mioblasti rigenerati derivati dalle
cellule satellite muscolo-rsidenti (Grounds e coll., 2002; LaBarge e Blau, 2002).
Perciò è discutibile il fatto che le cellule staminali non-muscolo-residenti
possano dare un significativo contributo alla rigenerazione del muscolo
scheletrico lesionato (Ground e coll., 2002). Oltre alle cellule satellite
classiche residenti nella parte più bassa della lamina basale, esiste un’altra
distinta popolazione di cellule staminali collocata extra-laminarmente,
all’interno del tessuto connettivo del muscolo scheletrico (Dreyfus e coll.,
2004), in risposta ad un evento lesivo a carico del muscolo scheletrico, queste
cellule prendono parte alla formazione dei mioblasti ed alla differenziazione
in miotubi (Chargé e Rudnicki, 2004). Dopo che i cilindri della vecchia lamina
basale sono stati riempiti con le miofibre rigenerate, le miofibre si estendono,
attraverso l’apertura della lamina basale, verso il tessuto connettivo
cicatriziale che si è formato tra i monconi sopravvissuti delle miofibre stesse
(Hurme e coll., 1991; Kalimo e coll., 1997). Su entrambe le parti della
cicatrice di tessuto connettivo, le miofibre ed i monconi delle fibre sopravvissute, nel tentativo di passare
attraverso la cicatrice che li separa, formano molteplici diramazioni, (Hurme e
coll., 1991). Dopo aver cercato di estendersi, per una corta distanza, le
diramazioni cominciano ad aderire al tessuto connettivo con le loro punte
finali, formando delle mini MTJs con il tessuto cicatriziale. Con l’andare del
tempo l’area cicatriziale progressivamente diminuisce nelle sue dimensioni,
conducendo i monconi in ferma aderenza l’un con l’altro (Vaittinen e coll.,
2002). Non è ancora comunque noto se i monconi delle fibre tranciate dalle
opposte parti del tessuto cicatriziale, si fonderanno tra loro totalmente alla fine del processo rigenerativo o se, al contrario, rimarrà tra di
loro qualche forma di setto di natura connettivale (Äärima e coll., 2004; Vaittinen
e coll., 2002). E’ stato inoltre ampiamante dimostrato come le capacità rigenerative del muscolo scheletrico, in risposta ad un
trauma, siano significativamente ridotte nel corso della vita (Järvinen e
coll., 1983). Questa diminuzione della capacità rigenerativa non è apparentemente attribuibile ad una
diminuzione del numero o dell’attività delle cellule satellite (Järvinen e
coll., 1983) ma piuttosto ad una complessiva diminuzione delle capacità
rigenerative del muscolo anziano, tanto che, ogni fase dei processi di riparazione, sembra rallentare e
deteriorarsi con l’avanzare dell’età (Järvinen e coll., 1983).
La rivascolarizzazione del muscolo lesionato
Un processo fondamentale nell’ambito
della rigenerazione del muscolo lesionato è rappresentato dalla rivascolarizzazione
dell’area insultata (Järvinen, 1976; Józsa e coll., 1980; Snow, 1973). Il
ripristino della vascolarizzazione nell’area lesa rappresenta il primo segno di
rigenerazione ed è un pre-requisito per i successivi recuperi morfologici e
funzionali del muscolo leso. La nuova rete capillare trae origine dai tronchi sopravvissuti dei vasi sanguigni
che si dirigono verso il centro dell’area lesa (Järvinen, 1976) e vanno a
fornire l’area stessa di un adeguato apporto di ossigeno permettendo, in tal
modo, il successivo ripristino funzionale del metabolismo aerobico, che rappresenta una tappa fondamentale
nell’ambito del processo di
rigenerazione delle miofibre. I giovani miotubi sono forniti di pochi mitocondri e posseggono solamente
una moderata capacità nell’ambito del meccanismo di ripristino energetico
aerobico ma hanno contestualmente chiaramente incrementato il meccanismo di ripristino energetico anaerobico (Järvinen
e Sorvari, 1978). Comunque, durante le fasi finali della rigenerazione, il
metabolismo aerobico costituisce la principale risorsa energetica per le
miofibre multinucleate (Järvinen e Sorvari, 1978). Questo particolare iter ripartivo,
fornisce anche una plausibile spiegazione del perché la rigenerazione delle
miofibre non progredisca oltre la fase precoce di formazione di sottili
miotubi, sino a quando la crescita di una sufficiente rete capillare non riesca
ad assicurare l’apporto di ossigeno necessario al ad un soddisfacente ripristino
funzionale del meccanismo aerobico (Järvinen, 1976; Järvinen e Sorvari, 1978).
La rigenerazione dei nervi intramuscolari
In modo simile a quanto
avvienga nel corso del processo di
rivascolarizzazione, la rigenerazione del muscolo scheletrico può essere anche
bloccata da un fallimento nella rigenerazione dei nervi intramuscolari (Hurme e
coll, 1991 ; Rantanen e coll., 1995; Vaittinen e coll., 1999; Vaittinen e
coll., 2001). La rigenerazione della miofibra continua dalla fase di formazione
dei miotubi anche in assenza dell’innervazione ma, se l’innervazione non fosse
completata correttamente, subentrerebbe inevitabilmente un processo di
atrofizzazione (Rantanen e coll., 1995). In caso di denervazione
neurogenica, ossia di rottura dell’assone, il processo di reinnervazione
richiede le ricrescita di un nuovo assone distalmente rispetto alla zona di
rottura. Tuttavia, dal momento che
gli assoni usualmente subiscono una rottura all’interno o nelle vicinanze del
muscolo, il contatto nervo-muscolo viene, in genere, rapidamente ristabilito
(Kalimo e coll., 1997).
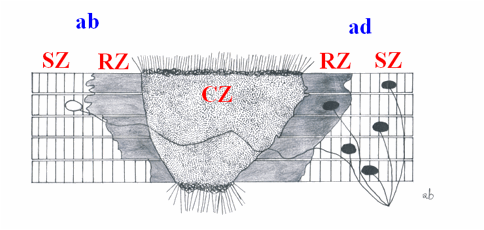
Figura 7: rappresentazione
schematica di un trauma da rottura del muscolo scheletrico. Le fibre muscolari lesionate si contraggono e il gap tra i monconi (la
zona centrale CZ) inizialmente comincia ad essere riempito dall’ematoma. Le
fibre muscolari sono necrotizzate all’interno della loro lamina basale, su di
una distanza che è compresa tra
circa 1 e 2 millimetri.
All’interno di questo segmento generalmente, col tempo, si verifica una
rigenerazione completa (zona di rigenerazione RZ), mentre nella parte di
muscolo che non viene direttamente lesa dal trauma, si osservano soltanto dei
cambiamenti di tipo reattivo (zona di sopravvivenza SZ). Ogni fibra muscolare è
innervata, in un singolo e ben preciso sito, da una giunzione neuromuscolare
(NMJs, punto pieno nello schema). Dal momento che le fibre muscolari si rompono
generalmente dall’una o dall’altra parte rispetto alla fila di NMJs delle
adiacenti fibre , i monconi accessori della fibra 1 e delle fibre che vanno
dalla 3 alla 5, del lato
“ad » (destro), rimangono innervati, mentre i loro monconi accessori dal
lato “ab” (sinistra), restano denervati. Nello stesso tempo il moncone
accessorio della fibra 2 è rimasto denervato, perché la sua NMJ si trova nella
zona RZ. La re- innervazione del moncone accessorio avverrà attraverso la
penetrazione di una nuova germogliazione assonale attraverso la zona
cicatriziale in formazione (CZ) e quindi grazie alla formazione di una nuova
NMJ nella zona SZ diametralmente opposta (rappresentata dal punto bianco nello
schema). La fibra 2 ritornerà alla sua normale reinnervazione quando il
processo rigenerativo nella zona RZ arriverà a completamento.
Figura 1: serie ecografica effettuata a livello del 1/3 medio della componente
muscolare del vasto mediale in un soggetto ventenne calciatore, in esiti di
trauma lacerativo, che evidenzia la presenza di una sottile quota fluida
paracentrale ipoanecogena di 31X7X4 mm, nel cui contesto si rilevano ponti di
fibrina e micro focolai di organizzazione della raccolta siero ematica. L’esame
ecotomografico è stato effettuato a 40 giorni dall’evento lesivo, il soggetto
non aveva effettuato nessun tipo di trattamento FKT.
Armstrong RB. Initial events in exercise induced muscular
injury. Med. Sci. Sports Exerc. 22: 429- 437, 1990.
Brewer BJ. Instructional
Lecture American Academy of Orthopaedic Surgeons 17: 354-358, 1960.
Brickson S., Hollander J., Corr DT., Ji LL.,
best TM. Oxidant production and immune
response after stretch injury in skeletal. Med Sci Sport Exerc. 33:
2010-2015, 2001.
Brickson S., Ji LL., Schell K., Olabisi R. St Pierre Schneider B., Best TM. M1/70 attenuates blood-borne neutrophil
oxidants, activation and myofiber damage following stretch injury. J Appl
Physiol. 95: 969-976, 2003.
Friden J., Lieber RL. Structural and mechanical basis of
the exercise-induced muscle injury. Med. Sci. Sports Exerc. 24: 521-530, 1992.
Garret WE. Jr., Califf JC., Basset FH. Histochemical correlates of hamstring
injuries. Am. J. Sports Med. 12: 98-103, 1984.
Garret WE. Muscle
strain injury: clinical and basic aspects. Med. Sci. Sports Exerc. 22:
439-443, 1990.
Garrett WE., Safran MR., Seaber AV. Biomechanical comparison of stimulated and
non stimulated skeletal muscle pulled to failure. Am.
J. Sports Med. 15: 448-454, 1987.
Hurme T.,
Kalimo H., Letho M., Järvinen
M. Healing of skeletal muscle injury: an ultrastructural and
immunohistochemical study. Med Sci Sport Exerc. 23: 801-810, 1191.
Kalimo H., Rantanen J., Järvinen M. Muscle injuries in sports. Baillieres
Clin Orthop. 2: 1-24, 1997.
Lieber RL., Woodburn TM., Friden J. Muscle damage induced by eccentric
contractions of 25% strain. J. Appl. Physiol. 70:
2498-2507, 1991.
McNeil PL. Repairing a torn cell surface: make way,
lysosomes to the rescue. J cell Sci. 115: 873-879, 2002.
Miyake K.,
McNeil PL., Suzuki K., Tsunoda R., Sugai N. An
actin barrier to realising. J Cell Sci . 114: 3487-3494, 2001.
Stauber WT. Eccentric
action of muscles: physiology, injury and adaptation. Exerc.
Sport Sci. Rev. 17:
157-185, 1989.
|
